創新產品要出口到其他國家,需要通過相關國家的審批程序。然而,由于各國的準入制度和標準不同,且程序往往繁瑣而漫長,阻礙了醫療創新在全球范圍內的推廣。為此,世界衛生組織啟動了預認證項目。
(健康時報記者徐瑤)創新產品要出口到其他國家,需要通過相關國家的審批程序。然而,由于各國的準入制度和標準不同,且程序往往繁瑣而漫長,阻礙了醫療創新在全球范圍內的推廣。為此,世界衛生組織啟動了預認證項目。
通過預認證的藥品和醫療產品會被列在WHO預認證產品清單上,成為各國政府和國際機構進行相關采購時,用以參照、指導決策的一項重要指標。
截至今年7月,中國有22個藥品和2個疫苗通過了WHO預認證,但在全球范圍內,這一數字仍處于較低水平。中國已是全球最大的原料藥生產國,讓更多產品達到國際水準,既要技術提升,也需理念轉變。
國產乙腦疫苗出口超4億支
所謂世界衛生組織預認證(WHO Pre-qualification, 簡稱PQ認證),是2001年啟動的聯合國行動計劃。簡單地說,世界衛生組織對藥品質量進行把關,如果藥品能獲得世衛組織的肯定,意味著它將有更大的機會出口到其他國家。因此,WHO預認證是藥品打開全球市場非常重要的一步。
2013年10月,中國生物技術股份下屬成都公司生產的乙型腦炎減毒活疫苗通過了WHO預認證,成為中國首個通過WHO預認證的疫苗產品。2015年,華蘭生物生產的流感疫苗也通過了預認證。
比爾及梅琳達·蓋茨基金會北京代表處副主任吳文達介紹,目前已有超過4億支乙腦疫苗被送到中國以外的地區,2015年老撾有150萬小孩接種了這款疫苗,這對整個公衛領域的影響非常大。
除了這兩款疫苗以外,通過預認證的還有藥品和診斷試劑。由世界衛生組織駐華代表處(北京)項目官員唐軼提供的數據顯示,從2004年至2017年7月,共有22款國產成品藥被列入WHO預認證產品清單上,包括依非韋倫、齊多夫定、無菌硫酸鏈霉素、米非司酮等。

資料圖
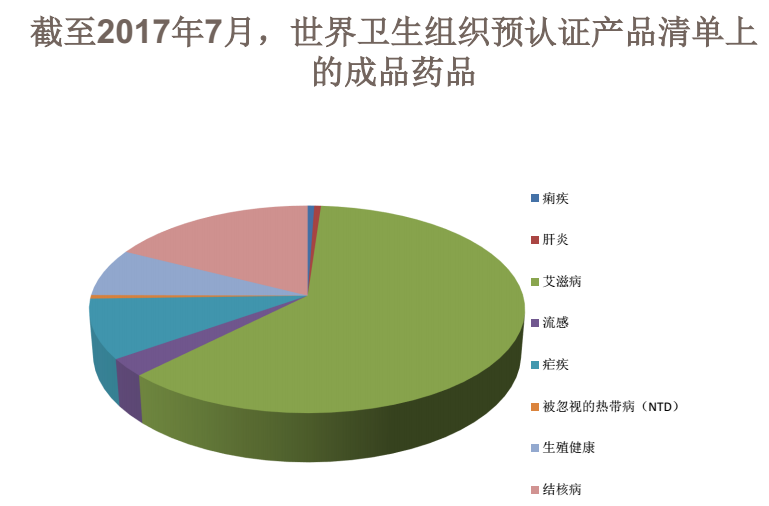
總的來看,一般申請WHO預認證的產品主要是一些疾病治療急需的藥品或醫療器械,比如抗艾滋病毒/艾滋病類藥物、瘧疾類藥物、結核類藥物、生殖健康藥物、流感藥物、急性腹瀉藥物和被忽視的熱帶疾病藥物以及部分抗癌藥品。
資料圖
與藥品不同的是,疫苗產品要通過預認證,有一個先決條件,即該國的疫苗監管體系必須先通過WHO的認可。2011年3月,中國的疫苗監管體系獲得WHO認可,中國疫苗進入國際市場的大門也從此打開。
吳文達介紹,目前中生集團的二價口服減毒脊灰疫苗、黃熱病疫苗,華蘭生物的流行性腦膜炎ACWY多糖疫苗,以及科興生物的甲肝疫苗等正在WHO預認證進程中。
中國預認證產品數遠低于印度
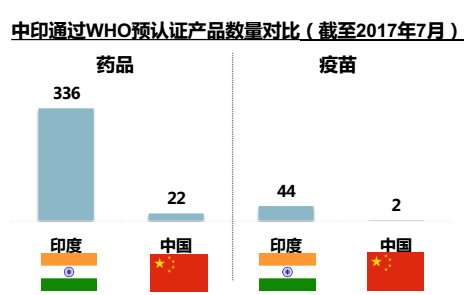
雖然已有越來越多的國產藥進入國際市場,但在WHO預認證的產品中,中國產品所占的比例不足4%,而印度的這一比例則為67.5%。截至2017年7月,印度有336個藥品和44款疫苗通過預認證。
資料圖
唐軼認為,很多時候企業在預認證前面臨的最大問題不是錢也不是技術,而是企業的質量管理體系相對薄弱。世衛組織的預認證不是一蹴而就的,通過后還要不斷維持和改善,因此這需要企業每個員工都意識到質量控制的重要性,這對于很多國內藥企是一個挑戰。另外是溝通問題,很多企業不知道怎么去達到WHO的要求。
中國目前已成為全球第二大藥品市場,有能力生產1600種化藥原料藥,供應全球40%的原料藥,但在成品制劑方面產業卻進步緩慢,眼見印度成為了仿制藥大國,比爾及梅琳達·蓋茨基金會北京代表處高級項目官陳園說。如今CFDA要求企業開展仿制藥一致性評價,以證明自己的制劑和原研藥在質量和療效上等效。對于那些國際化起步早、已有制劑產品通過歐美國家認可的企業,將借著新政斬獲更多市場份額。
同時,隨著中國加入國際人用藥品注冊技術協調會(ICH),藥物臨床試驗將與國際同步。可以預見,更多中國醫藥產品將走出國門,通過WHO預認證標準或歐美國家注冊標準的中國仿制藥數量可能呈井噴趨勢。