7月5日,江西省藥品監管局發布的《藥品生產監督檢查及處理情況通報》(以下簡稱《通報》)顯示,江中藥業股份有限公司因存在11項一般缺陷被江西省藥監局責令整改。
近幾年,明星產品銷量縮減,產品廣告被疑虛假宣傳,銷售費用遠超研發投入,增資藥企被曝質量問題……曾以“家中常備江中牌健胃消食片”家喻戶曉的江中藥業煩惱不斷,甚至被媒體評價為“消化不良”。業界關心,江中藥業是否遭遇發展瓶頸?
控股企業產品因質量問題屢被處罰
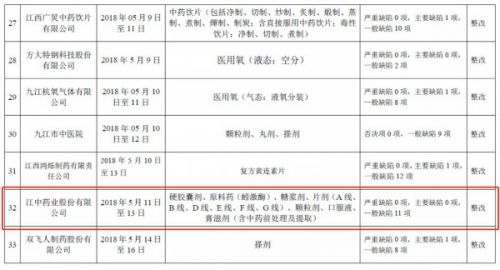
《通報》顯示,江西省藥監局在2018年5月11~13日組織對江中藥業“硬膠囊劑、原料藥(蚓激酶)、糖漿劑、片劑(A線、B線、D線、E線、F線、G線)、顆粒劑、口服液、膏滋劑(含中藥前處理及提取)”進行檢查,結果為:存在一般缺陷11項。
而此前,江中藥業控股51%的江西南昌濟生制藥有限責任公司也曾屢次因產品質量問題被藥品監管部門“點名”。
今年1月31日,原南昌市食品藥品監管局對濟生制藥生產銷售按劣藥論處的健兒清解液(批號:170519,規格:每瓶裝120ml)作出行政處罰,沒收其生產銷售劣藥違法所得43800元,并處生產銷售劣藥貨值金額一倍的罰款43800元。
而早在2017年3月8日,原南昌市食藥監局就曾對濟生制藥生產銷售劣藥利巴韋林片作出罰款、沒收違法所得、沒收藥品的行政處罰。
明星產品身陷“質疑門”
根據江中藥業2018年年報,江中藥業主要從事非處方藥、保健品及功能食品的生產、研發與銷售。非處方藥類業務主要包括江中牌健胃消食片、江中牌乳酸菌素片、江中牌草珊瑚含片等品種。保健品及功能食品業務主要包括初元和參靈草。
作為企業明星產品之一,近年來,江中牌健胃消食片卻遭遇藥監部門、工商部門、媒體、會計師事務所等多方質疑。
記者查詢發現,2009年,標示為江中藥業生產的、批號為0710029 的健胃消食片,因“重量差異、含量測定”不達標被廣東省藥監部門列為不合格藥品。同年7月23日,江中藥業發布澄清公告指出,經鑒定,上述江中健胃消食片為假冒產品,并非江中藥業生產。
2012年3月8日,上海工商部門通過其官方微博發布2012年第一號虛假違法廣告公告。其中,江中藥業子公司江西江中醫藥貿易有限責任公司發布的廣告宣稱,“江中牌兒童健胃消食片”的銷量為“每天賣出71萬盒”。經工商部門調查,這一數字與事實嚴重不符,屬于欺騙和誤導消費者。
近年來,江中牌健胃消食片作為企業產量億級的主營產品,產銷量整體呈下滑趨勢。而江中牌健胃消食片和江中牌乳酸菌素片作為江中藥業主要廣告品種,2015~2017年,企業每年廣告投入超過2.5億元,2018年為1.94億元。
今年3月13日,大信會計師事務所在審計報告中曾提出質疑:“貴公司2018年度發生銷售費用5.03億,其中廣告宣傳費1.94億、薪酬福利1.96億。銷售費用發生額較大,對貴公司合并報表利潤的影響較為重要,我們將銷售費用的真實性和完整性識別為關鍵審計事項”。
江中藥業回應
針對問題產品被通報等問題,記者近日采訪了江中藥業相關負責人。
江中藥業相關負責人對江西省藥監局《通報》中指出的“11項一般缺陷”及產品質量問題,江中藥業回復稱,《通報》提及的是2018年5月江西省藥監部門對藥企的例行交叉飛行檢查。而一般缺陷主要指檢查中發現記錄填寫錯誤或簽名錯誤、容器無狀態標識等。本次檢查結果為一般缺陷,并已于2018年5月完成整改,對其后續生產經營沒有影響。
此外,對控股企業濟生制藥曾被曝產品質量不合格問題,江中藥業稱,將積極梳理和規劃濟生制藥產品和業務,從原料采購、人員配置、設備管理、生產過程、質量控制、包裝運輸等各個方面完善和優化管控體系,嚴守質量和品質防線。目前濟生制藥已進行關鍵產品的生產設備升級和工藝技術改進,并加強原材料采購驗收和生產過程的監控。